Vào năm 2020, ước tính có khoảng 2.3 triệu trường hợp mắc mới ung thư vú trên toàn cầu, chiếm 12% số ca mới được chẩn đoán ung thư. Ung thư vú là nguyên nhân của 685.000 trường hợp tử vong mỗi năm. Cùng với sự phát triển của công nghệ, việc phát hiện ung thư vú ngày càng được cải thiện, tỷ lệ tử vong cũng giảm trong vài năm trở lại đây ở các nước phương Tây, tuy vậy, ung thư vú vẫn là nguyên nhân hàng đầu gây tử vong liên quan đến ung thư trên toàn thế giới. Đa số các bênh nhân ung thư vú giai đoạn sớm có thể được chữa bằng nhiều biện pháp khác nhau, nhưng tỷ lệ thành công tùy thuộc nhiều vào giai đoạn lâm sàng và subtype của chẩn đoán ung thư vú.
Đầu năm 2024, Hiệp hội Ung thư Nội khoa Châu Âu (European Society of Medical Oncology – ESMO) đã công bố hướng dẫn chẩn đoán, kiểm soát và theo dõi ung thư vú giai đoạn sớm. Bài viết nhằm tóm tắt điểm chính của hướng dẫn đến bạn đọc.
SÀNG LỌC, CHẨN ĐOÁN, SINH BỆNH HỌC VÀ SINH HỌC PHÂN TỬ
Khuyến cáo
- Chụp nhũ ảnh thường xuyên (mỗi 2 năm) được khuyến cáo ở phụ nữ trong độ tuổi 50 – 69 có nguy cơ trung bình [I, A]. Chụp nhũ ảnh cũng có thể được cân nhắc ở phụ nữ 45 – 59 tuổi và 70 – 74 tuổi, mặc dù có ít bằng chứng về lợi ích ở phụ nữ trong độ tuổi này [I, B].
- Sàng lọc ở phụ nữ có tiền sử gia đình hoặc có dòng mầm BRCA1/2 và các biến thể có nguy cơ gây bệnh khác nên tuân thủ hướng dẫn của ESMO để làm giảm nguy cơ và theo dõi ung thư vú và buồng trứng di truyền [III, A].
- Các bước chẩn đoán tiếp theo tùy thuộc vào kết quả xét nghiệm và chẩn đoán hình ảnh, bao gồm nhũ ảnh 2 bên và siêu âm cả 2 vú và các hạch bạch huyết vùng hoặc chụp nhũ ảnh kỹ thuật số 2 chiều (two-dimensional digital mammography) ở bệnh nhân có triệu chứng [I, A].
- Chụp nhũ ảnh kỹ thuật số cắt lớp (kèm hoặc không kèm theo chụp nhũ ảnh tổng hợp) và chụp nhũ ảnh tăng cường độ tương phản có thể được cân nhắc để thay thế nếu có thể và hợp lý [II, B].
- Chụp cộng hưởng từ vú được khuyến cáo ở những trường hợp không chắc chắn về chỉ đoán khi chỉ dựa trên chẩn đoán hình ảnh tiêu chuẩn và ở những trường hợp lâm sàng đặc biệt (chẳng hạn ung thư vú gia đình có liên quan đến đột biến dòng mầm BRCA1/2 (gBRCA1/2m) và các biến thể có nguy cơ cao khác hoặc ung thư tiểu thùy, nghi ngờ ung thư đa ổ (multifocality)/đa vùng (multicentricity), bệnh nhân có đặt túi ngực) [I, A].
- Đánh giá di căn xa (xương, gan và phổi) chỉ được khuyến cáo ở bệnh nhân ung thư giai đoạn ≥ IIb (đặc biệt là ở bệnh nhân có hạch bạch huyết phì đại), bệnh nhân có nguy cơ tái phát cao khi được chẩn đoán ban đầu và/hoặc bệnh nhân có triệu chứng [III, A].
- Đánh giá sinh bệnh học tiền điều trị, bao gồm hình thái mô (histomorphological), hóa mô miễn dịch (immunohistochemical) và phân tử được khuyến cáo khi chẩn đoán nếu có thể và nên bao gồm mô học khối u tiên phát và mô học/tế bào học hạch bạch huyết ở nách (nếu nghi ngờ) [I, A].
- Đánh giá nên bao gồm loại mô bệnh học, phân độ và hóa mô miễn dịch của thụ thể estrogen (ER), thụ thể progesterone (PgR) và thụ thể yếdu tố tăng trưởng thượng bì người 2 (HER2) và dấu chỉ tăng trưởng khối u (proliferation marker) chẳng hạn như Ki-67 [I, A]. FISH test nên được thực hiện ở các trường hợp có điểm hóa mô miễn dịch HER2 khả nghi (HER2 2+) [I, A].
- Khối u nên được phân nhóm theo subtype sinh học, định danh dựa trên kết quả mô học và hóa mô miễn dịch thường quy, chẳng hạn như luminal A, luminal B, HER2 (+) và bộ ba âm tính [I, A].
- Đối với bệnh nhân ung thư vú có HR (-), HER2 (-) mà không chắc chắn về các chỉ định của hóa trị thiệu bổ trợ (sau khi đã cân nhắc tất cả các yếu tố lâm sàng và bệnh học), có thể áp dụng đánh giá biểu hiện gen và đáp ứng nội tiết tiền phẫu [II, B].
- Tế bào lympho thâm nhiễm khối u (tumour-infiltrating lymphocytes – TIL) có thể bổ sung thông tin cho công tác tiên lượng và chẩn đoán, đặc biệt là ở bênh nhân ung thư vú bộ ba âm tính và HER (+) nhưng chưa có ngưỡng TIL rõ ràng để đưa ra quyết định điều trị [I, B].
- Mức độ biểu hiện của programmed death-ligand 1 (PD-L1) khoogn nên được sử dụng để đưa ra quyết định điều trị ở bệnh nhân ung thư vú giai đoạn sớm [I, E].
- Xét nghiệm dòng mầm và tư vấn di truyền về sau cho các biến thể BRCA1/2 nên được đề xuất cho bệnh nhân phù hợp và cho bệnh nhân có thể được điều trị bổ trợ với olaparib [I, A].
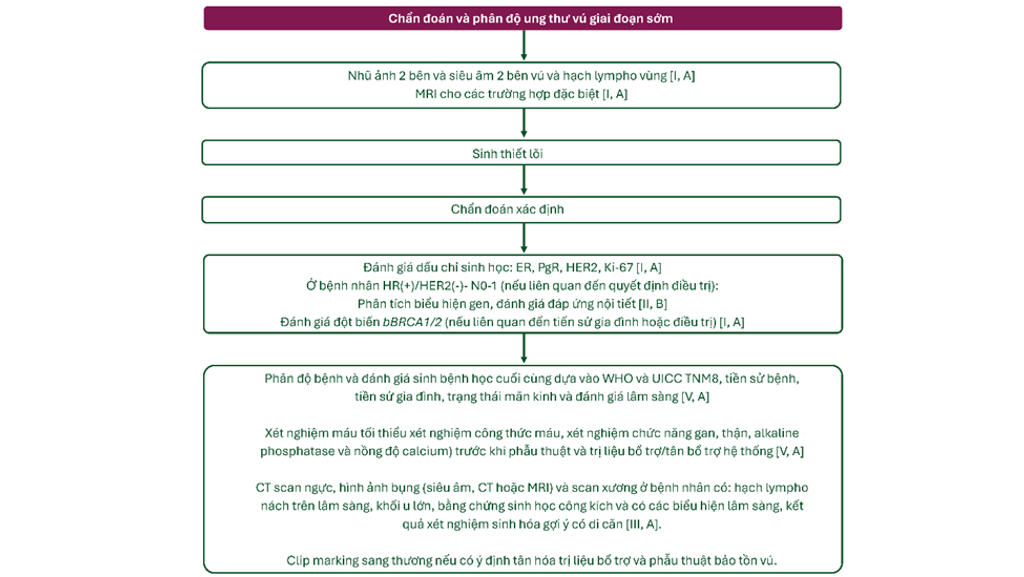
Hình 1. Quy trình chẩn đoán và phân độ ung thư vú giai đoạn sớm
KHUYẾN CÁO PHÂN ĐỘ GIAI ĐOẠN VÀ ĐÁNH GIÁ NGUY CƠ
- Giai đoạn bệnh và đánh giá sinh bệnh cuối cùng nên được đưa ra dựa trên phân loại của Tổ chức Y tế Thế giới (WHO) và Tổ chức kiểm soát Ung thư Quốc tế (UICC) [V, A].
- Xét nghiệm máu cơ bản (công thức máu toàn bộ, xét nghiệm chức năng gan, thận, alkaline phosphatase và nồng độ calci) được khuyến cáo trước khi phẫu thuật và điều trị với liệu pháp bổ trợ hệ thống/tân bổ trợ hệ thống [V, A].
- Chụp CT ngực, bụng (siêu âm, CT hoặc MRI) và scan xương có thể được cân nhắc ở bệnh nhân có:
- Dương tính trên lâm sàng với hạch ở nách
- Khối u lớn
- Bằng chứng sinh học công kích
- Dấu hiệu lâm sàng, biểu hiện hoặc kết quả xét nghiệm sinh hóa gợi ý có di căn [III, A].
- Tiền sử bệnh và tiền sử gia đình hoàn chỉnh nen được đánh giá, bao gồm cả trạng thái mãn kinh (nếu khi ngờ, nên đo lường nồng độ estradiol huyết thanh và nồng độ hormone kích thích nang trứng) [V, A].
- 18F-FDG PET/CT có thể được lựa chọn thay vì CT và xạ hình xương, đặc biệt là ở bệnh nhân có nguy cơ cao nếu không thể đưa ra kết luận chỉ dựa trên các biện pháp truyền thống [II, B].
KIỂM SOÁT UNG THƯ VÚ GIAI ĐOẠN SỚM
Nguyên tắc điều trị chung
Hướng dẫn cung cấp các khuyến cáo để tối ưu hóa điều trị. Tuy nhiên, quyết định điều trị cho mỗi bệnh nhân nên được đưa ra dựa trên phân tích lợi ích-nguy cơ được cá nhân hóa sau khi cân nhắc các đặc điểm, gánh nặng bệnh tật và sở thích của bệnh nhân. Quyết định điều trị nên được đưa ra dựa trên sau khi thảo luận với bệnh nhân. Nên để bệnh nhân tham gia vào quyết định điều trị khi có thể.
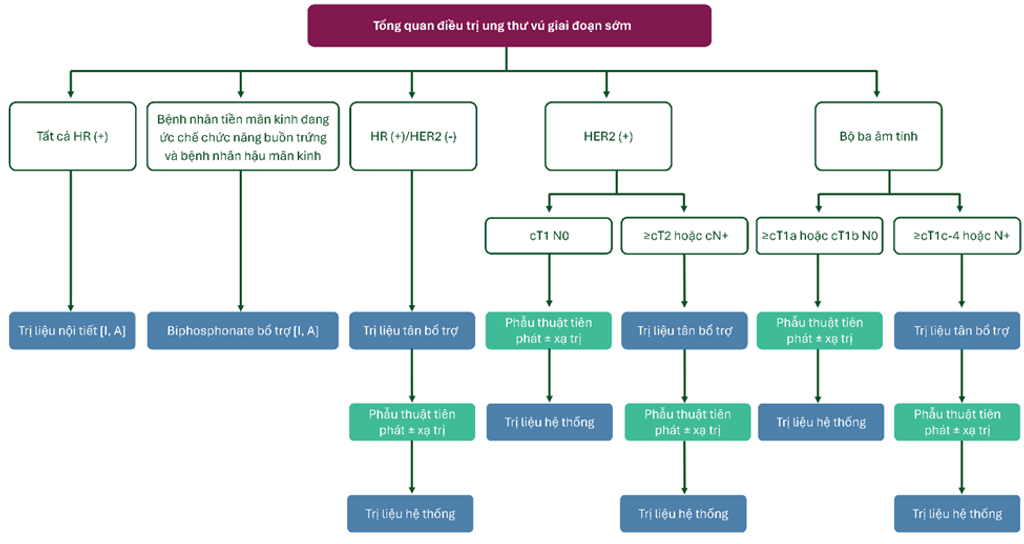
Hình 2. Tổng quan điều trị ung thư vú giai đoạn sớm
Khuyến cáo
- Khi có thể, điều trị nên được thực hiện tại chuyên khoa/trung tâm ung bướu/ung thư vú bởi đội nhóm hợp tác liên ngành có thể tư vấn chuyển bệnh nhân đến chuyên khoa phù hợp [III, A].
- Tham gia vào các thử nghiệm lâm sàng được khuyến cáo [V, A].
- Chiến lược điều trị cho mỗi bệnh nhân nên dựa trên kết quả phân tích lợi ích – nguy cơ sau khi cân nhắc gánh nặng của khối u (kích thước, vị trí của khối u tiên phát, số lượng sang thương và tình trạng phì đại hạch bạch huyết), sinh học (sinh bệnh học, bao gồm dấu chỉ sinh học và biểu hiện gen), tuổi tác, trạng thái mãn kinh, tổng trạng sức khỏe và sở thích của bệnh nhân [I, A].
- Tuổi tác nên được cân nhắc với các yếu tố khác và không nên là yếu tố xác định đầu tiên khi đưa ra quyết định điều trị [IV, A].
- Sinh sản và bảo tồn sinh sản nên được thảo luận với bệnh nhân chưa mãn kinh trẻ tuổi (bất kể giai đoạn bệnh) trước khi bắt đầu bất kỳ biện pháp điều trị hệ thống nào [V, A].
Khuyến cáo điều trị tại chỗ – tại vùng (locoregional treatment)
- Phẫu thuật bảo tồn vú với xạ trị hậu phẫu là lựa chọn điều trị tại chỗ được ưu tiên cho đa số bệnh nhân ung thư vú giai đoạn sớm [I, A].
- Phẫu thuật cắt bỏ toàn bộ tuyến vú được chỉ định/ưu tiên, phẫu thuật tái tạo vú cũng nên được ưu tiên, ngoại trừ khối u viêm tiên phát và các khối u khác có nguy cơ cao có thể ảnh hưởng đếu điều trị nếu điều trị toàn thân/xạ trị chậm trễ [V, A].
- Sinh thiết hạch gác là phẫu thuật tiêu chuẩn ở mọi bệnh nhân không có biểu hiện của hạch bạch huyết trên hình ảnh học và thăm khám [I, A].
- Nếu chưa từng được điều trị hệ thống trước đây, bệnh nhân di căn với kích thước nhỏ (micrometastatic) và bệnh nhân có biểu hiện hạch gác hạn chế (chỉ 1-2 hạch gác) ở bệnh nhân không có biểu hiện của hạch bạch huyết trên hình ảnh học và thăm khám, phẫu thuật bảo tồn vú kèm theo xạ trị toàn bộ vú sau đó, rồi đến cả phần dưới của nách và điều trị bổ trợ hệ thống mà không cần phẫu thuật khác ở vùng nách [II, A].
- Cắt bỏ hạch bạch huyết ở nách sau khi có kết quả sinh thiết hạch gác dương tính với < 3 hạch gác liên quan chỉ được khuyến cáo ở bệnh nhân có nhiều gánh nặng bệnh tật do hạch bạch huyết ở nách hoặc ảnh hưởng đến quyết định điều trị bổ trợ hệ thống về sau [II, A].
- Kế hoạch phẫu thuật sau liệu pháp điều trị hệ thống ban đầu nên cân nhắc tình huống sau khi điều trị hệ thống ban đầu [II, A].
- Xạ trị toàn bộ vú được khuyến cáo sau khi phẫu thuật bảo tồn vú [I, A].
- Chiến lược xạ trị giảm số phân liều được khuyến cáo: trung bình (15 – 16 liều với ≤ 3 Gy/liều/ngày cho mọi chỉ định xạ trị hậu phẫu) và xạ trị giảm tối đa số phân liều (26 Gy trong phân liều 5 ngày cho toàn bộ vú hoặc thành ngực (không có tái tạo)) [I, A].
- Xạ trị một phần tuyến vú sử dụng máy tăng tốc là liệu pháp điều trị thay thế cho xạ trị toàn bộ vý ở bệnh nhân mắc ung thư vú xâm lấn và ung thư vú in situ có nguy cơ tái phát tại chỗ thấp [I, A].
- Xạ trị sau khi cắt bỏ tuyến vú được khuyến cáo cho bệnh nhân mắc ung thư vú giai đoạn sớm có nguy cơ cao, bao gồm diện cắt có liên quan, ≥ 4 hạch bạch huyết nách có liên quan, khối u T3 – T4 và có nhiều yếu tố nguy cơ khác [I, A].
- Xạ trị sau khi cắt bỏ tuyến vú nên được ân nhắc ở bệnh nhân có nguy cơ trung bình, bao gồm bệnh nhân có 1-3 hạch bạch huyết nách dương tính [I, A].
- Xạ trị hạch bạch huyết được khuyến cáo cho bệnh nhân có hạch hạch huyết dương tính (đích điều trị tùy thuộc vào yếu tố nguy cơ bao gồm số lượng hạch bạch huyết liên quan, giai đoạn ung thư và đáp ứng với liệu pháp điều trị toàn thân đầu tiên [I, B].
- Nếu được chỉ định, xạ trị sau khi cắt bỏ tuyến vú có thể được tiến hành sau khi phẫu thuật tía tạo vú nhanh chóng [III, A].
Khuyến cáo điều trị ung thư vú giai đoạn sớm HR (+), HER2 (-)
- Mọi ung thư kiểu luminal nên được điều trị với liệu pháp nội tiết [I, A].
- Đa số khối u kiểu luminal A không cần hóa trị liệu, ngoại trừ bệnh nhân có nhiều gánh nặng bệnh tật [I, A].
- Trong trường hợp không chắc chắn về chỉ định của hóa trị liệu bổ trợ (sau khi cân nhắc các yếu tố lâm sàng và sinh bệnh học), có thể sử dụng kết quả kiểm tra biểu hiện gen hoặc đánh giá đáp ứng nội tiết để đưa ra quyết định điều trị về hóa trị liệu bổ trợ [I, A].
- Ung thư HR (+) luminal B, HER2 (-) luminal B nên được điều trị với hóa trị liệu sau khi điều trị với liệu pháp nội tiết. Hóa trị liệu nên được cân nhắc ở bệnh nhân có nguy cơ lâm sàng cao (chẳng hạn như có nhiều hạch bạch huyết dương tính, bệnh nhân tiền mãn kinh có hạch bạch huyết dương tính, tiến triển tại chỗ) và bệnh nhân có 0 – 3 hạch bạch huyết liên quan và có nguy cơ cao (chẳng hạn như kết quả đánh giá biểu hiện gen cho thấy nguy cơ cao) [I, A].
- Bệnh nhân tiền mãn kinh nên được đơn trị với tamoxifen (luminal A, giai đoạn I) [I, A] hoặc nếu bệnh nhân có nguy cơ tái phát cao, ức chế buồng trứng với chất ức chế chức năng buồng trứng (OFS)-tamoxifen hoặc OFS – chất ức chế aromatase[I, A].
- Bệnh nhân hậu mãn kinh nên được điều trị với chất ức chế aromatasehoặc tamoxifen sau khi đã điều trị với chất ức chế aromatase[I, A].
- Tamoxifen có thể được lựa chọn cho bệnh nhân có nguy cơ thấp hoặc không dung nạp chất ức chế aromatase[I, A].
- Biphosphonate (cho đến 5 năm) được khuyến cáo ở bệnh nhân không có chức năng buồng trứng (hậu mãn kinh hoặc đang ức chế chức năng buồn trứng), đặc biệt là ở bệnh nhân có nguy cơ tái phát cao [I, A] hoặc bệnh nhân bị mất xương do điều trị [I, A].
- Bổ sung abemaciclib trong vòng 2 năm vào trị liệu nội tiết sau khi hoàn thành điều trị tại chỗ – tại vùng không nên được cân nhắc ở bệnh nhân ung thư vú giai đoạn sớm giai đoạn III hoặc giai đoạn II có nguy cơ cao [I, A].
- Liệu pháp nội tiết dài hơn 5 năm nên được cân nhắc ở bệnh nhân ung thư vú giai đoạn sớm có nguy cơ cao [I, A]. Thời gian điều trị trong vòng 7 – 8 năm có thể hợp lý với đa số bệnh nhân có nguy cơ cao [I, A].
- Sau khi hoàn thành điều trị tại chỗ – tại vùng và điều trị tân bổ trợ/bổ trợ, olaparib bổ trợ 1 năm được khuyến cáo cho bệnh nhân ung thư vú giai đoạn sớm có gBRCA1/2 và HER 2 (-), HR (+) với nhiều hạch bạch huyết dương tính sau phẫu thuật ban đầu hoặc bệnh nhân ung thư vú giai đoạn sớm có nguy cơ tồn dư cao sau hóa trị liệu tân bổ trợ [I, A].
- Trị liệu nội tiết nên đi kèm với olaparib bổ trợ ở bệnh nhân có gBRCA1/2m [I, A].
- Olaparib và abemaciclib không nên phối hợp do độc tính chồng lấp, nhưng có thể được kê đơn theo thứ tự (olaparib trước) [V, A].
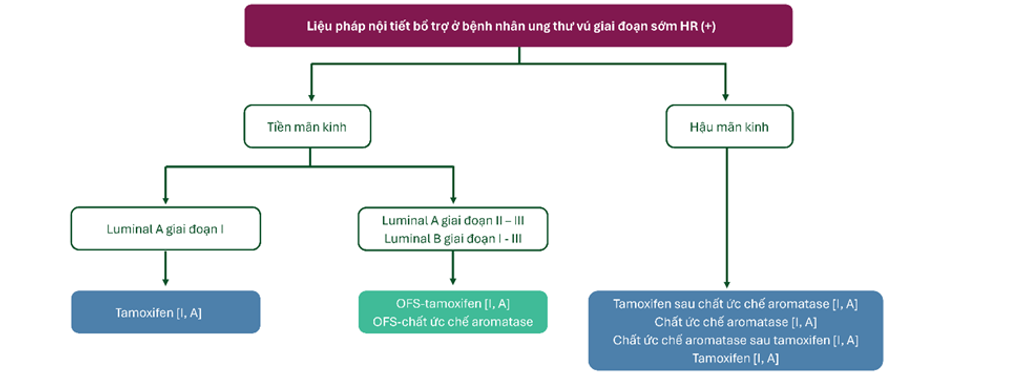
Hình 3. Vai trò của trị liệu nội tiết bổ trợ ở bệnh nhân ung thư vú giai đoạn sớm HR (+)
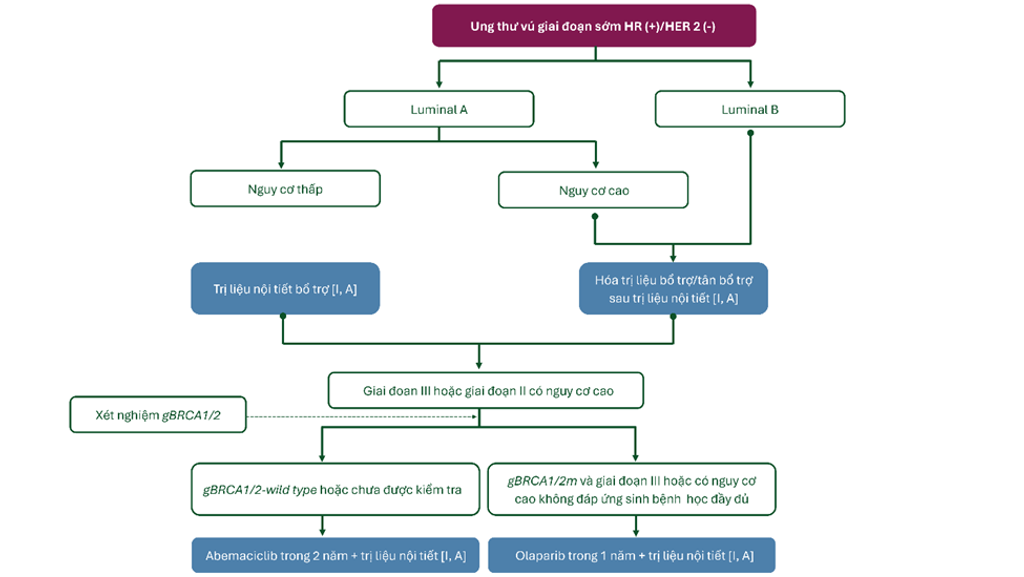
Hình 4. Điều trị hệ thống bệnh nhân ung thư vú giai đoạn sớm HR (+), HER2 (-)
Khuyến cáo điều trị ung thư vú giai đoạn sớm HER2 (+)
- Trị liệu trực tiếp trên HER2 (với hóa trị liệu đồng thời khởi phát) nên kéo dài trong 12 tháng, bao phủ cả giai đoạn tân trị liệu bổ trợ và/hoặc trị liệu bổ trợ [I, A].
- Có thể phổi hợp (nếu được chỉ định) với xạ trị và trị liệu nội tiết [I, A]. Ở nhóm bệnh nhân có nguy cơ thấp có chọn lọc, 6 tháng trị liệu anti HER2 có thể không thua kém.
- Đánh giá tim mạch thường xuyên được khuyến cáo (trước, trong khi và sau trị liệu) trước khi bắt đầu hóa trị liệu [II, B].
- Đối với bệnh nhân ung thư vú HER2 (+) giai đoạn II – III, hóa trị liệu tân bổ trợ hệ thống với liệu pháp anti HER2 bao gồm trastuzumab–pertuzumab là lựa chọn được ưu tiên [I, A].
- Đối với hóa trị liệu xương sống, phác đồ anthracycline – taxane hoặc taxane – carboplatin dựa trên bằng chứng độc lập với việc sử dụng liệu pháp tân bổ trợ hoặc liệu pháp bổ trợ [I, A].
- Chẹn kép với trastuzumab–pertuzumab (so với trastuzumab đơn trị) phối hợp với háo trị liệu đạt được tỷ lệ đáp ứng sinh bệnh học hoàn chỉnh cao hơn và được khuyến cáo cho liệu pháp tân bổ trợ [I, A].
- Bệnh nhân có bệnh xâm lấn tồn dư (không đáp ứng sinh bệnh học hoàn chỉnh sau hóa trị liệu tân bổ trợ và trị liệu anti HER2) nên được điều trị bổ trợ với trastuzumab emtansine với 14 chu kỳ [I, A].
- Bệnh nhân ung thư vú giai đoạn sớm giai đoạn I HER2 (+), có thể tiến hành phẫu thuật ban đầu [III, B], tiếp đến điều tri bổ trợ trong 12 tuần với paclitaxel với trastuzumab trong 1 năm nếu giai đoan lâm sàng được xác nhận bởi sinh bệnh học [III, B].
- Ở bệnh nhân dương tính với hạch bạch huyết, bổ sung pertuzumab với trastuzumab nên được cân nhắc ở bệnh nhân được điều trị bổ trợ bất kể trạng thái HR [I, A].
- Bệnh nhân HR (+) có nguy cơ cao có thể được cân nhắc để mở rộng điều trị với neratinib trogn 1 năm sau khi hoàn thành 1 năm điều trị với trastuzumab hoặc trị liệu dựa trên nền tảng trastuzumab [I, B].
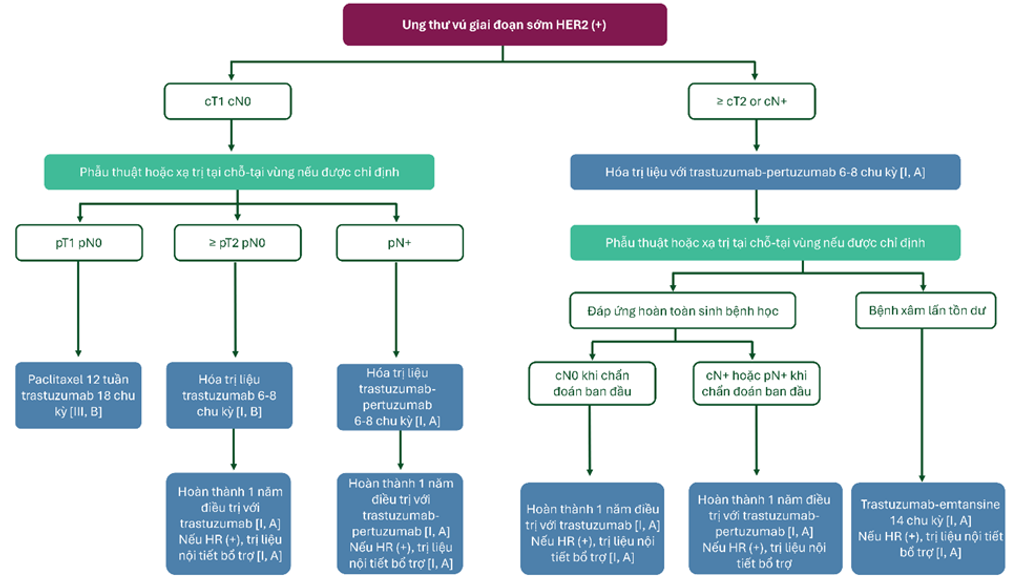
Hình 5. Kiểm soát bệnh nhân ung thư vú giai đoạn sớm HER2 (+)
Khuyến cáo điều trị ung thư vú giai đoạn sớm bộ 3 âm tính
- HER2 (-) với biểu hiện ER và/hoặc PgR 1 – 9% là nhóm bệnh không đồng nhất, một số bệnh nhân có biểu hiện sinh học tương tự bộ ba âm tính. Chiến lược điều trị nên được điều chỉnh cho nhóm bệnh nhân này, do nhóm bệnh nhân này có thể có đáp ứng cao hơn với hóa trị liệu và giảm hiệu lực của trị liệu nội tiết so [II, B].
- Ung thư bộ ba âm tính nên được hóa trị liệu kèm theo hoặc không kèm theo thuốc ức chế điểm kiểm soát miễn dịch (chẳng hạn pembrolizumab) [I, A], ngoại trừ bệnh nhân âm tính với hạch bạch huyết thuộc subtype mô học đặc biệt chẳng hạn như ung thư biểu mô nang tuyến (adenoid cystic carcinoma) hoặc secretory carcinoma hoặc có nguy cơ lâm sàng rất thấp (pT1a pN0) [II, B].
- Hóa trị liệu nên kéo dài trong 12 – 24 tuần (4-8 chu kỳ), tùy htuoojc vào giai đoạn ung thư, loại phác đồ và bất kể thuốc ức chế điểm kiểm soát miễn dịch sử dụng [I, A].
- Khi lựa chọn hóa trị liệu có liệu trình dày với yếu tố kích thích dòng bạch cầu hạt, nên được cân nhắc do lợi ích được ghi nhận vượt trội hơn liệu trình bình thường [I, A].
- Đối với cT1c-4 N0 hoặc bộ ba âm tính N âm tính bất kỳ, trị liệu bổ trợ được ưu tiên [I, A].
- Đối với cT2-4 N0 hoặc bộ ba âm tính (giai đoạn II – III) N âm tính bất kỳ nên được điều trị với hóa trị liệu tân bổ trợ kèm với pembrolizumab, trừ khi bệnh nhân có yếu tố nguy cơ ngộ độc miễn dịch liên quan đến thuốc ức chế điểm kiểm soát miễn dịch quá mức [I, A].
- Pembrolizumab nên được kê đơn mỗi 3 tuần trong suốt pha điều trị bổ trợ [I, A] và trong 9 chu kỳ 3 tuần trong suốt pha điều trị bổ trợ, bất kể trạng thái đáp ứng hoàn toàn sinh bệnh học [I, A].
- Bệnh nhân được điều trị với pemprolizumab nên được theo dõi chặt chẽ các biến cố có hại do độc tính miễn dịch trong quá trình điều trị [V, A].
- Chất ức chế điểm kiểm soát miễn dịch không nên được kê đơn để điều trị bổ trợ mà không có điều trị tân bổ trợ với chất ức chế điểm kiểm soát miễn dịch trước đó [V, D].
- Bệnh nhân gBRCA1/2m và bệnh nhân ung thư vú bộ ba âm tính có nguy cơ cao (không có đáp ứng hoàn toàn sinh bệnh học hoặc ung thư giai đoạn II – III) nên được điều trị bổ trợ với olaparib trong 1 năm [I, A].
- Phối hợp chất ức chế điểm kiểm soát miễn dịch và olaparib có thể được cân nhắc ở một số bệnh nhân [V, C].
- Bệnh nhân có bệnh tồn dư không được điều trị với thuốc ức chế điểm kiểm soát miễn dịch nên được điều trị bổ trợ với capecitabine 6 – 8 chu kỳ [I, A].
- Không nên chỉ định phối hợp olaparib và capecitabine ở bệnh nhân gBRCAm [V, C].
- Phối hợp chất ức chế điểm kiểm soát miễn dịch và capecitabine có thể được cân nhắc ở một số bệnh nhân [V, C].
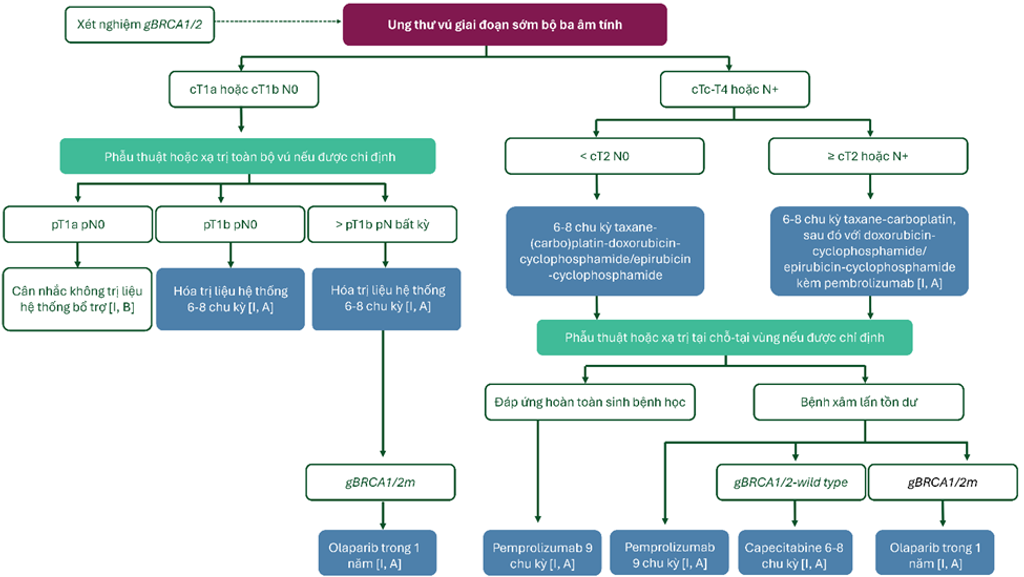
Hình 6. Kiểm soát bệnh nhân ung thư vú giai đoạn sớm bộ ba âm tính
KHUYẾN CÁO THEO DÕI VÀ CÁC BIẾN CHỨNG LÂU DÀI
Cân nhắc chung
- Theo dõi thường quy mỗi 3 tháng được khuyến cáo trong 3 năm đầu tiên sau khi hoàn thành điều trị (mỗi 6 tháng cho bệnh nhân ung thư vú giai đoạn sớm có nguy cơ thấp), mỗi 6 tháng kể từ năm thứ 4 – 5 và mỗi năm sau đó nữa. Khoảng cách giữa các lần thăm khám có thể thay đổi tùy theo nguy cơ tái phát và nhu cầu của bệnh nhân [I, A].
- Chụp nhũ ảnh 2 bên hàng năm (sau khi điều trị bảo tồn vú) hoặc nhũ ảnh đối bên (sau khi cắt bỏ vú) được khuyến cáo, kèm với siêu âm và MRI vú khi cần [II, A].
- Bệnh nhân sống sót sau ung thư vú nên tham gia các chương trình theo dõi quốc gia cho các bệnh ung thư khác [V, B].
- Ở bệnh nhân không có triệu chứng, xét nghiệm sinh hóa hoặc hình ảnh học khác không được khuyến cáo [I, D].
- Thăm dò theo triệu chứng nên được cân nhắc [V, B].
- Đánh giá mật độ xương thường xuyên được khuyến cáo cho bệnh nhân được điều trị với chất ức chế aromatase hoặc bệnh nhân được điều trị với chất ức chế chức năng buồng trứng [I, A].
- Ở bệnh nhân không có triệu chứng với chức năng tim bình thường đã được điều trị với biện pháp có thể gây độc trên tim nên được theo dõi tim mạch [III, B].
- Đối với bệnh nhân được điều trị với tamoxifen, kiểm tra phụ khoa hàng năm được khuyến cáo [V, B]. Tuy nhiên, siêu âm đầu dò không được khuyến cáo [V, D].
Những cân nhắc liên quan đến sinh sản và sinh dục
- Mãn kinh sớm, vô sinh và rối loạn chức năng sinh dục nên được thảo luận và xử trí với bệnh nhân trước khi bắt đầu điều trị nếu phù hợp [V, A].
- Bệnh nhân tiền mãn kinh cân nhắc mang thai nên được thông tin về các bằng chứng cho thấy bệnh nhân có thể mang thai sau khi điều trị ung thư vú [III, A].
- Đối với bệnh nhân rất mong muốn mang thai, gián đoạn trị liệu nội tiết bổ trợ tạm thời sau 18 – 30 tháng điều trị với trị liệu nội tiết cho phép thải trừ kéo dài trong 3 tháng và mang thai trong 2 năm, sau đó tái điều trị với trị liệu nội tiết. Chế độ điều trị ngắt quãng này không gây ảnh hưởng đến kết quả ung thư vú ngắn hạn ở bệnh nhân ung thư vú giai đoạn sớm HR (+), HER2 (-) có nguy cơ thấp.
Cân nhắc tâm lý
- Bệnh nhân nên được vận động tuân thủ lối sống lành mạch, tập thể dục thường xuyên, tránh tăng cân và hạn chế uống rượu [II, A].
- Những nhu cầu cho cuộc sống lâu dài sau khi điều trị ung thư như công việc, tâm sinh lý, giai đình và sinh dục nên được xử trí [V, A].
Nguồn:
Bài viết được lược dịch từ Loibl S, André F, Bachelot T, et al; ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Early breast cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2024 Feb;35(2):159-182. doi: 10.1016/j.annonc.2023.11.016.







