Vào ngày 07 tháng Tư vừa qua, nghiên cứu về hiệu quả của semaglutide ở bệnh nhân béo phì liên quan đến suy tim phân suất tống máu bảo tồn đã được báo cáo tại Hội nghị Thường niên của Viện Tim mạch Hoa Kỳ (ACC) năm 2024.
Trong các thử nghiệm STEP – HFpEF và STEP – HFpEF DM, chất chủ vận thụ thể GLP – 1 đã cho thấy khả năng cải thiện triệu chứng, hạn chế về thể chất, cân nặng và chức năng vận động ở bệnh nhân béo phì liên quan đến suy tim phân suất tống máu bảo tồn. Nghiên cứu này tiến hành phân tích dân số gộp (pooled analysis) của cả 2 thử nghiệm STEP – HFpEF và STEP – HFpEF DM để đưa ra đánh giá cuối cùng cho hiệu quả của semaglutide [1]. Bài viết nhằm tóm tắt kết quả của phân tích này.
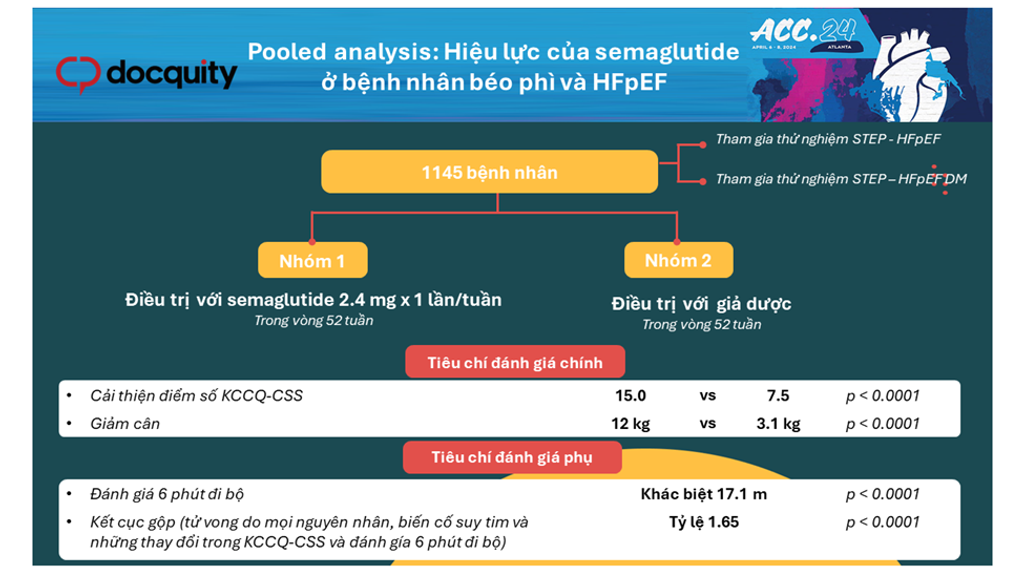
Hình 1. Tóm tắt kết quả phân tích dân số gộp
Thử nghiệm STEP – HFpEF và thử nghiệm STEP – HFpEF DM
Thử nghiệm STEP – HFpEF đã được tiến hành nhằm đánh giá hiệu quả của chất chủ vận thụ thể GLP – 1 semaglutide ở bệnh nhân suy tim phân suất tống máu bảo tồn và có BMI ≥ 30 kg/m2 mà không mắc đái tháo đường type 2. Đây là thử nghiệm đầu tiên đánh giá hiệu quả của chất chủ vận thụ thể GLP – 1 ở bệnh nhân béo phì liên quan đến suy tim phân suất tống máu bảo tồn. Nghiên cứu STEP – HFpEF đã cho thấy semaglutide hỗ trợ cải thiện có ý nghĩa triệu chứng, hạn chế thể chất, chức năng vận động và cân nặng so với giả dược[2].
Với mục đích tương tự thử nghiệm STEP – HFpEF, thử nghiệm STEP – HFpEF DM được tiến hành trên bệnh nhân béo phì liên quan đến suy tim phân suất tống máu bảo tồn và đái tháo đường type 2. Kết quả cho thấy semaglutide cải thiện có ý nghĩa kết cục suy tim so với giả dược [3].
Phân tích dân số gộp (pooled analysis)
Nghiên cứu phân tích dân số gộp từ 2 thử nghiệm lâm sàng STEP – HFpEF và STEP – HFpEF DM. Các thử nghiệm này được tiến hành tại 129 điểm nghiên cứu lâm sàng ở 18 quốc gia. Trong cả 2 thử nghiệm, bệnh nhân tham gia nghiên cứu đều ≥ 18 tuổi, mắc suy tim với phân suất tống máu thất trái ≥ 45%, có BMI ≥ 30 kg/m2, triệu chứng suy tim II – IV theo phân độ suy tim New York, điểm số Kansas City Cardiomyopathy Questionnaire Clinical Summary Score (KCC1 – CSS, nhằm đo lường các triệu chứng và hạn chế thể chất liên quan đến suy tim) < 90 điểm. Người tham gia nghiên cứu từ thử nghiệm STEP – HFpEF không mắc đái tháo đường, trong khi người tham gia nghiên cứu thử nghiệm STEP – HFpEF DM được chẩn đoán mắc đái tháo đường. Trong cả 2 thử nghiệm, những người tham gia nghiên cứu đều được phân ngẫu nhiên thành 2 nhóm để điều trị với semaglutide liều 2.4 mg x 1 lần/tuần hoặc giả dược trong vòng 52 tuần [1].
Tiêu chí đánh giá chính bao gồm những thay đổi của các chỉ số KCCQ – CSS và cân nặng sau 52 tuần theo dõi so với đường nền ở những bệnh nhân tham gia nghiên cứu STEP – HFpEF và STEP – HFpEF DM. Tiêu chí đánh giá phụ bao gồm những thay đổi đối với đánh giá 6 phút đi bộ, tiêu chí gộp (tử vong do mọi nguyên nhân, biến cố suy tim và những thay đổi trong KCCQ-CSS và đánh gía 6 phút đi bộ) và nồng độ C-reactive protein (CRP) sau 52 tuần theo dõi so với đường nền [1]. Nồng độ CRP cũng giảm có ý nghĩa ở nhóm được điều trị với semaglutide so với nhóm giả dược [1].
Kết quả nghiên cứu
Phân tích bao gồm tổng 529 bệnh nhân từ thử nghiệm STEP – HFpEF và 616 bệnh nhân từ thử nghiệm STEP – HFpEF DM. Tổng cộng có 1145 bệnh nhân được bao gồm trong phân tích dân số gộp (với 573 bệnh nhân được điều trị với semaglutide và 572 bệnh nhân được điều trị với giả dược).
Sau 52 tuần theo dõi, những cải thiện về điểm số KCCQ-CSS và cân nặng giảm cao hơn có ý nghĩa ở nhóm bệnh nhân được điều trị với semaglutide 2.4 mg x 1 lần/tuần [1]. Cụ thể, sự khác biệt trung bình về KCCQ-CSS giữa 2 nhóm semaglutide và giả dược là 7.5 điểm và sự khác biệt trung bình về cân nặng giảm giữa 2 nhóm semaglutide và giả dược là – 8.4%.
Đối với tiêu chí đánh giá phụ, kết quả đánh giá 6 phút đi bộ và tiêu chí gộp (tử vong do mọi nguyên nhân, biến cố suy tim và những thay đổi trong KCCQ-CSS và đánh gía 6 phút đi bộ) được cải thiện có ý nghĩa ở nhóm điều trị với semaglutide so với giả dược. Hiệu lực của semaglutide luôn tương tự khi phân tích giữa các nhóm phụ, bao gồm phân nhóm theo tuổi tác, chủng tộc, giới tính, BMI, huyết áp tâm thu, CRP nền và phân suất tống máu thất trái.
Kết luận
Semaglutide vượt trội hơn giả dược trong việc cải thiện triệu chứng liên quan đến suy tim, những hạn chế thể chất và giảm cân ở bệnh nhân mắc đồng thời béo phì và suy tim. Tuy nhiên, cần lưu ý rằng cả 2 thử nghiệm STEP – HFpEF và STEP – HFpEF DM đều được tiến hành trước khi SGLT2i được chấp thuận để điều trị cho bệnh nhân suy tim phân suất tống máu bảo tồn. Các thử nghiệm lâm sàng ngẫu nhiên với quy mô đủ lớn cần được tiến hành trong tương lai để thẩm định hiệu lực của semaglutide đối với các tiêu chí quan trọng của suy tim phân suất tống máu bảo tồn.
Tài liệu tham khảo
- Butler J, Shah SJ, Petrie MC et al; STEP-HFpEF Trial Committees and Investigators. Semaglutide versus placebo in people with obesity-related heart failure with preserved ejection fraction: a pooled analysis of the STEP-HFpEF and STEP-HFpEF DM randomised trials. Lancet. 2024 Apr 4:S0140-6736(24)00469-0. doi: 10.1016/S0140-6736(24)00469-0.
- Kosiborod MN, Abildstrøm SZ, Borlaug BA, et al. Semaglutide in patients with heart failure with preserved ejection fraction and obesity. N Engl J Med 2023; 389: 1069–84.
- Kosiborod MN, Petrie MC, Borlaug BA, et al; STEP-HFpEF DM Trial Committees and Investigators. Semaglutide in Patients with Obesity-Related Heart Failure and Type 2 Diabetes. N Engl J Med. 2024 Apr 18;390(15):1394-1407. doi: 10.1056/NEJMoa2313917.







